Il marchio CE alla valvola cardiaca transcatetere SAPIEN 3 estende l’indicazione per la TAVI in Europa a tutti i pazienti con stenosi aortica
Grazie ai risultati dello studio PARTNER 3, pubblicato sul New England Journal of Medicine, la protesi valvolare cardiaca SAPIEN 3 di Edwards Lifesciences è la prima che sarà possibile impiantare in qualunque paziente con stenosi aortica, indipendentemente dall’età e dal grado di rischio per l’intervento cardiochirurgico tradizionale
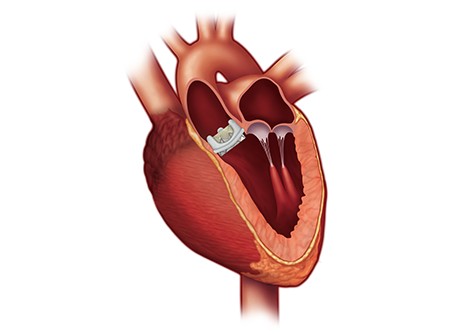 La protesi valvolare cardiaca transcatetere SAPIEN 3 di Edwards Lifesciences ha ottenuto il marchio CE per l’utilizzo al trattamento anche dei pazienti con diagnosi di stenosi aortica a basso rischio per la chirurgia a cuore aperto. È il primo dispositivo per impianto transcatetere di valvola aortica (TAVI) a conseguire questa indicazione in Europa.
La protesi valvolare cardiaca transcatetere SAPIEN 3 di Edwards Lifesciences ha ottenuto il marchio CE per l’utilizzo al trattamento anche dei pazienti con diagnosi di stenosi aortica a basso rischio per la chirurgia a cuore aperto. È il primo dispositivo per impianto transcatetere di valvola aortica (TAVI) a conseguire questa indicazione in Europa.
L’estensione dell’indicazione d’uso in Europa deriva dai risultati dello studio PARTNER 3, pubblicati sulla rivista New England Journal of Medicine, a primavera di quest'anno. PARTNER 3 è uno studio clinico randomizzato e valutato in modo indipendente, che ha confrontato i risultati tra TAVI e cardiochirurgia tradizionale a cuore aperto, con utilizzo della valvola SAPIEN 3, in pazienti a basso rischio chirurgico. La TAVI con il sistema SAPIEN 3 è risultata superiore, con una riduzione del 46 per cento del tasso di eventi composito per mortalità per tutte le cause, ictus e ri-ospedalizzazione a un anno.
Un ulteriore studio, pubblicato online sulla rivista Journal of American College of Cardiology, ha valutato la qualità di vita nei pazienti arruolati nel PARTNER 3. Ha dimostrato significativi vantaggi immediati e duraturi per i pazienti a basso rischio trattati con la valvola SAPIEN 3. Da un confronto tra TAVI e cardiochirurgia tradizionale nei pazienti a basso rischio, i pazienti trattati con la TAVI hanno mostrato un miglioramento più rapido rispetto ai pazienti che hanno subito un intervento chirurgico. Inoltre, questo studio ha evidenziato, per la prima volta, che i pazienti trattati con la valvola SAPIEN 3 godono di una migliore qualità di vita anche un anno dopo la procedura.
«I dati dei trial sui pazienti a basso rischio hanno evidenziato come la TAVI sia da considerare una valida alternativa alla sostituzione valvolare chirurgica anche in questo gruppo di persone –commenta Giuseppe Tarantini, Presidente della Società italiana di cardiologia interventistica (Gise) e Professore e Direttore dell’UOSD Cardiologia interventistica del Dipartimento di scienze cardiologiche, toraciche e vascolari del Policlinico universitario di Padova. Sull’onda di questi risultati, la Food and Drug Administration ha già approvato l’utilizzo delle valvole TAVI nei pazienti a basso rischio e oggi questo avviene in Europa anche per questa valvola, con la concessione del marchio CE. Gli studi citati hanno arruolato pazienti con un’età media poco sopra i 70 anni, e dunque nel prossimo futuro saranno disponibili anche dati definitivi sulla durata delle protesi transcatetere rispetto a quelle chirurgiche. Va sottolineato che al momento attuale i dati disponibili in letteratura non mostrano alcun allarme circa la supposta minore durata delle protesi transcatetere, testata sino a 8-10 anni, non essendoci follow-up più lunghi al momento.»
Le valvole transcatetere SAPIEN sono tra le più studiate, con oltre 30.000 pazienti trattati nell’ambito di studi clinici o registri, in oltre 65 paesi in tutto il mondo. Dalla prima approvazione commerciale di una protesi valvolare transcatetere SAPIEN in Europa nel 2007, le valvole SAPIEN sono state impiantate in centinaia di migliaia di pazienti in tutto il mondo. Valvola di ultima generazione SAPIEN 3, approvata per la prima volta in Europa a gennaio 2014 per il trattamento di pazienti ad alto rischio e, in un secondo momento, anche per quelli a rischio intermedio, è frutto della pluri-decennale esperienza di Edwards Lifesciences nello sviluppo di protesi valvolari impiegate sia per la TAVI sia per la cardiochirurgia tradizionale.
«Questa nuova indicazione per l’uso in pazienti a basso rischio di questa valvola per TAVI in Europa dovrebbe facilitare un cambiamento nelle linee guida della pratica clinica e nelle procedure di rimborso in Italia e in molti Paesi europei», conclude l’esperto.
Edwards Lifesciences, con sede a Irvine, California, è leader mondiale nel trattamento delle malattie strutturali del cuore, nel monitoraggio chirurgico e nella terapia intensiva. Dedicata a sviluppare soluzioni innovative per la cura dei pazienti, collabora con la comunità medica e scientifica per salvare vite e migliorare la qualità di vita.
Per informazioni: www.Edwards.com; Twitter @EdwardsLifesci
Edwards, Edwards Lifesciences, il logo E e Edwards Sapien, Edwards Sapien 3, Sapien, Sapien 3, Partner e Partner 3 sono marchi registrati da Edwards Lifesciences Corporation. Tutti gli altri marchi sono di proprietà dei loro rispettivi proprietari. Questa dichiarazione è rilasciata per conto di Edwards Lifesciences Corporation e/o d
© Pensi che questo testo violi qualche norma sul copyright, contenga abusi di qualche tipo? Contatta il responsabile o Leggi come procedere

