Proprietà ANTI-AGING dei funghi terapici
È sempre più alto l’interesse verso gli effetti dei funghi medicinali in numerose patologie, molte delle quali associate a stress ossidativo e a danni cellulari indotti da radicali liberi. Grazie al loro potenziale nutritivo e di modulazione del sistema immunitario alcuni funghi sono diventati un nuovo target terapeutico anche in termini di anti-aging.
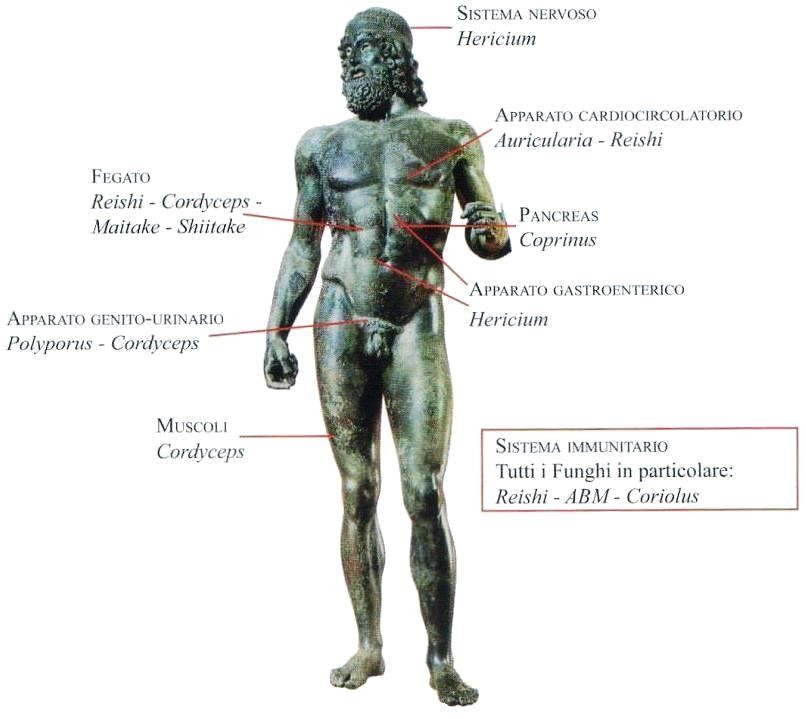 Nella tradizionale accezione della micoterapia, l’azione dei funghi in medicina anti-aging è mirata soprattutto a conseguire un effetto adattogeno, inquadrabile come il ripristino dell’equilibrio dell’organismo. In questo contesto i funghi medicinali risultano essere dei “tonici” in grado di permettere una migliore gestione dello stress e di conseguire un riequilibrio generale dell’organismo, ripristinandone il funzionamento ottimale. I funghi, inoltre, contengono vitamine, minerali e molecole farmacologicamente bioattive; sono ricchi dal punto di vista nutrizionale, ma hanno un contenuto calorico basso. La loro ricchezza nutrizionale e “farmacologica”, grazie alla naturale sinergia dei vari composti, fa sì che questi alimenti, assunti in toto, possano esprimere un potenziale “salutistico” estremamente positivo e poliedrico.
Nella tradizionale accezione della micoterapia, l’azione dei funghi in medicina anti-aging è mirata soprattutto a conseguire un effetto adattogeno, inquadrabile come il ripristino dell’equilibrio dell’organismo. In questo contesto i funghi medicinali risultano essere dei “tonici” in grado di permettere una migliore gestione dello stress e di conseguire un riequilibrio generale dell’organismo, ripristinandone il funzionamento ottimale. I funghi, inoltre, contengono vitamine, minerali e molecole farmacologicamente bioattive; sono ricchi dal punto di vista nutrizionale, ma hanno un contenuto calorico basso. La loro ricchezza nutrizionale e “farmacologica”, grazie alla naturale sinergia dei vari composti, fa sì che questi alimenti, assunti in toto, possano esprimere un potenziale “salutistico” estremamente positivo e poliedrico.
Un aspetto che esula dal contesto di questo volume è l’azione di alcuni funghi come supporto biologico in oncologia, ma la loro capacità di supportare il sistema immunitario, attivando la risposta dell’organismo contro la progressione di queste patologie, è di rilievo anche nel contesto della medicina anti-aging, proprio per le capacità immunostimolanti e immunomodulanti che caratterizzano questi funghi. Inoltre, in corso di chemioterapia o radioterapia, spesso sono risultati in grado di ridurre gli effetti collaterali e di proteggere i tessuti sani dai possibili danni iatrogeni.
Gli estratti di funghi medicinali sono utilizzati infatti anche per migliorare la qualità della vita nel corso delle terapie oncologiche, alleviando gli effetti collaterali di radio e chemioterapia, come la stanchezza, la riduzione dell’appetito, la deplezione midollare e il rischio di infezioni opportunistiche.
NON SOLO: l’azione immunomodulante dei polisaccaridi dei funghi è anche impiegata come trattamento dolce e non invasivo e nella prevenzione della metastatizzazione neoplastica, in particolare nell’ambito della medicina orientale. Composti bioattivi purificati derivati da funghi medicinali rappresentano così una nuova potenziale fonte importante di presenti e soprattutto futuri agenti antitumorali [1]. L’assunzione regolare di funghi medicinali o di loro estratti può esercitare un effetto preventivo sia per l’elevata attività antitumorale [2,3] sia per l’inibizione dell’incidenza di metastasi.
È noto che i funghi medicinali rappresentano una fonte potenziale di composti biologicamente attivi con attività immunomodulante, scavenger dei radicali liberi, antinfiammatoria, antibatterica, antimicotica, antivirale, epatoprotettiva e antidiabetica. Inoltre, sostanze estratte da funghi sono risultate in grado di interagire con particolari vie di segnalazione intracellulare correlate a processi come l’infiammazione, la differenziazione cellulare e la sopravvivenza, l’apoptosi, l’angiogenesi e la progressione del tumore e delle sue metastasi [4].
I funghi rientrano sicuramente in quella che viene definita immunonutrizione, che è la capacità di modulare l’attività del sistema immunitario attraverso l’utilizzo di specifici nutrienti. L’immunonutrizione può essere utilizzata ogni volta che si ritenga necessario riequilibrare la risposta immunitaria cellulare (TH1) e umorale (TH2).
Da queste considerazioni deriva il loro impiego non solo in ambiti patologici specifici, ma anche nel contesto dell’healthy aging medicine [5].
GANODERMA LUCIDUM (REISHI)
È un fungo saprofita che cresce in primavera inoltrata, estate e autunno su ceppi di latifoglie, specialmente di quercia, castagno e anche olivo (Figura 15.1); produce in particolare un gruppo di triterpeni chiamati acidi ganodergici (in grado di limitare la produzione di istamina, ottimizzando così la respirazione cellulare e favorendo la funzionalità epatica) e contiene altri importanti composti quali polisaccaridi (ad esempio β-glucani), cumarina, mannitolo, xilosio, galattosio e alcaloidi. Contiene tutti gli amminoacidi essenziali ed è particolarmente ricco in lisina e leucina; ha un basso contenuto totale di grassi e un’alta percentuale di acidi grassi polinsaturi relativamente agli acidi grassi totali [6]. L’analisi elementare dei corpi di Ganoderma lucidum ha rilevato la presenza di oligoelementi quali fosforo, silicio, zolfo, potassio, calcio, magnesio, ferro, sodio, zinco, rame, manganese, stronzio, SELENIO E GERMANIO [7].
Nella medicina naturale cinese il Ganoderma lucidum è considerato un fungo adattogeno, cioè una sostanza che favorisce l’adattamento dell’organismo umano a differenti situazioni ambientali. Numerosi preparati polisaccaridici raffinati estratti da questo fungo sono presenti in commercio come trattamento “over-the-counter” per le malattie cronico-degenerative, tra cui le neoplasie maligne e le epatopatie [8]. La recente letteratura scientifica ne ha suggerito l’impiego in oncologia, nel trattamento delle metastasi, ad esempio di quelle legate alle neoplasie mammarie, avanzando in questo caso l’ipotesi di un’inibizione degli oncogeni proinvasivi, cioè corresponsabili dell’invasività delle cellule metastatiche [9]. Si prevede che in futuro saranno vari gli ambiti di ricerca e applicazione clinica in questi contesti, che però esulano dagli obiettivi didattici di questo articolo.
Data la sua crescente popolarità, sono in corso numerosi studi sulla composizione e sugli effetti sulla salute correlabili al Ganoderma lucidum, compresi gli effetti antitumorali, la regolazione del glucosio nel sangue, l’azione antiossidante, antibatterica e antivirale e gli effetti a protezione del fegato e sulle lesioni gastriche [10]. La combinazione di beneficio in assenza di evidente tossicità ha pertanto favorito la diffusione di questo fungo nella pratica clinica come integratore nutrizionale. Molti degli studi pubblicati negli ultimi anni sono basati prevalentemente su modelli animali, colture cellulari e sulla valutazione in vitro degli effetti sulla salute e, solo più di recente, anche su procedimenti di sperimentazione umana in vivo. Tuttavia, non c’è un corpo coeso di ricerca e la valutazione obiettiva di questa terapia tradizionale in termini di benefici sulla salute umana non resta chiaramente e universalmente stabilita [11].
Un recente studio in vitro ha evidenziato anche la sua attività neuroprotettiva, che giustifica un ulteriore studio di tali estratti di funghi in modelli animali allo scopo di valutare le loro sicurezza ed efficacia come base per successive prove cliniche; infatti, potrebbero rappresentare un approccio neuroprotettivo preventivo nelle malattie neurodegenerative in soggetti a rischio [12].
In medicina anti-aging l’impiego di questo fungo è variabile: da un effetto aspecifico sulla qualità di vita e contro le malattie cronico-degenerative a uno neuroprotettivo e potenziativo [13]. Il range posologico nel contesto della medicina preventiva (non a scopo terapeutico specifico, in cui si devono impiegare dei dosaggi decisamente maggiori) va da 250 a 750 mg al giorno suddivisi in due-tre somministrazioni. Spesso viene utilizzato a cicli: 3 mesi consecutivi seguiti da un mese di pausa e quindi ripresa del trattamento, procedendo con lo stesso andamento periodico.
LENTINUS EDODES (SHIITAKE)
La Lentinula (o Lentinus) edodes è un fungo basidiomicete di origine asiatica ed è attualmente il secondo fungo commestibile più consumato al mondo (Figura 15.2). È più comunemente conosciuto con il nome di shiitake (che significa letteralmente “fungo della quercia”). In Cina e in Giappone è utilizzato da centinaia di anni come immunomodulante e, insieme al fungo Cordyceps sinensis, a scopo energizzante e anti-aging.
Una vasta bibliografia evidenzia le potenzialità immunomodulanti [14,15], antiossidanti [16] e antinfiammatorie del fungo e dei suoi estratti [17]. La Lentinula edodes presenta un’attività antinfiammatoria anche a livello intestinale, risultando efficace per il trattamento della sindro¬me del colon irritabile (Irritable Bowel Syndrome, IBS) grazie all’inibizione dell’espressione mRNA mediata dell’IL-8 associata all’inibizione dell’attività del NF-kB [18].
La molecola lentinano, isolata dallo shiitake, è un β-D-glucano con catena 1,3:1,6 e prende il nome proprio da questo fungo. È una molecola ben studiata ed è ritenuta responsabile di molti degli effetti benefici riconducibili al Lentinus edodes. Studi clinici hanno associato il lentinano a un’aspettativa di vita più alta, una migliore qualità di vita e a una bassa incidenza di tumori; viene anche impiegato in associazione con altri chemioterapici nel contesto di terapie oncologiche [19]. Più di recente sono state individuate nuove molecole proteiche ad attività oncosoppressiva grazie agli effetti apoptotici sulle cellule tumorali senza conseguenze negative sulle cellule sane, tra le quali si possono ricordare la LFP(91-3)A2 e la latcripin-13 [20,21].
Dalla Lentinula edodes è stato estratto anche l’AHCC (Active Hexose Correlated Compound), un α-glucano ben tollerato, con attività antiossidanti, antinfiammatorie e immunomodulanti, oltre che antiproliferative [22-24]. In medicina anti-aging l’impiego di questo fungo è variabile: da un effetto aspecifico sulla qualità di vita e contro le malattie cronico-degenerative a uno antiossidante, antinfiammatorio e potenziativo. Il range posologico nel contesto della medicina preventiva (non a scopo terapeutico specifico, in cui si devono impiegare dosaggi decisamente maggiori) dipende dalla formulazione in commercio, in quanto lo si può trovare sotto forma sia di polvere secca sia di estratto secco standardizzato (in genere titolato 10:1). Indicativamente, come apporto puro, si suggerisce una posologia di 2.000-2.500 mg al giorno. Spesso viene utilizzato a cicli: 3 mesi consecutivi seguiti da un mese di pausa e quindi ripresa del trattamento, procedendo con lo stesso andamento periodico.
TRAMETES (CORIOLUS) VERSICOLOR
Si tratta di una Polyporacea a mensola dal basidioma variopinto, appartenente alla classe dei Basidiomycetes (Figura 15.3); è una specie molto comune in Europa e in tutto il resto del mondo, nota per la variabilità del colore, da cui il nome “versicolor”. Non è infrequente osservarla su ceppi di legno destinati alla coltivazione del fungo “pioppino”. Il Trametes versicolor è un fungo tradizionalmente utilizzato nella medicina orientale come tonico, immunomodulante e adattogeno. Due sostanze estratte dal fungo, il polisaccaride K (PSK) e il polisaccaride-peptide (PSP), sono state studiate come possibili trattamenti complementari in svariate tipologie di neoplasie maligne [25,26]. ll polisaccaride K (PSK), estratto dal Coriolus, è un farmaco utilizzato in Giappone per il trattamento del cancro. Quando usato come coadiuvante, il PSK è risultato in grado di migliorare il tasso di sopravvivenza dei pazienti con tumori gastrici [27] e colorettali [28].
Altri estratti di Coriolus, come il polisaccaride-peptide (PSP) e il polisaccaride versicolor (VPS), sono disponibili anche come integratori alimentari. Al VPS sarebbero da ricondursi altri benefici legati al suo impiego come nutraceutico [29]. Studi recenti hanno anche evidenziato una sua attività protettiva a livello del DNA [30]. Analisi del DNA hanno dimostrato che l’estratto dei funghi Coriolus è risultato in grado anche di inibire l’espressione di geni regolatori del ciclo cellulare e di sopprimere il comportamento metastatico attraverso l’inibizione dell’adesione cellulare, della migrazione cellulare e dell’invasività delle cellule [31].
In medicina anti-aging l’impiego di questo fungo è variabile: da un effetto aspecifico sulla qualità di vita e nella “prevenzione” delle malattie cronico-degenerative a uno antiossidante, immunomodulante e potenziativo. Il range posologico nel contesto della medicina preventiva (non a scopo terapeutico specifico, in cui si devono impiegare dosaggi decisamente maggiori) dipende dalla formulazione in commercio, in quanto lo si può trovare sotto forma sia di polvere secca sia di estratto secco standardizzato. Indicativamente, come apporto puro, si suggerisce una posologia di 500-2.500 mg al giorno. Spesso viene utilizzato a cicli: 2 mesi consecutivi seguiti da un mese di pausa e quindi ripresa del trattamento, procedendo con lo stesso andamento periodico.
GRIFOLA FRONDOSA (MAITAKE)
La Grifola frondosa (o Grifos frondosus) è un fungo non molto diffuso, che cresce soprattutto sotto gli alberi di castagno, faggio e quercia; appartiene alla famiglia delle Meripilaceae. È anche conosciuto con il nome di maitake ed è un fungo commestibile con un grande corpo fruttifero caratterizzato da “cappucci sovrapposti”; infatti, i corpi fruttiferi crescono sovrapponendosi tra loro e formando un “gruppo”. È un ottimo alimento in cucina, nonché un fungo medicinale. È ricco di minerali (in particolare potassio, ferro, calcio e magnesio), vitamine (riboflavina, niacina e un precursore della vitamina D), polisaccaridi (grifolano e grifolina), fibre e aminoacidi. Il principio attivo primario, tuttavia, è dato da una miscela di β-glucani, tra cui spicca il cosiddetto “Grifon-D” o “Maitake-D-Fraction”. La frazione D, la frazione MD e gli altri estratti, spesso in combinazione con il frutto intero del fungo in polvere, hanno dimostrato di avere un’importante azione immunomodulante; infatti la Grifola frondosa influenza positivamente il sistema immunitario, soprattutto grazie all’attivazione di alcuni meccanismi protettivi che influiscono sull’azione delle cellule NK, dei macrofagi e delle cellule T [32], modulando anche il rapporto tra T-helper 1 e 2 [33].
Secondo l’US National Cancer Institute, complessi polisaccaridi presenti nella Grifola frondosa sembrano avere una significativa attività antitumorale. Tuttavia, l’esatto meccanismo molecolare dell’effetto antitumorale non è stato ancora del tutto chiarito. Ad esempio, la Maitake-D-Fraction è in grado di indurre l’apoptosi delle cellule del cancro al seno attraverso l’espressione genica del BCL2-Antagonist/Killer 1 (BAK1) [34]. Recenti studi scientifici hanno evidenziato come questa frazione sia in grado di sopprimere il fenotipo tumorale mammario attraverso un meccanismo molecolare che modifica l’espressione di alcuni geni, come IGFBP-7, ITGA2, ICAM3, SOD2, CAV-1, Cul-3, NRF2, Cycline E, ST7 e SPARC, coinvolti nella stimolazione dell’apoptosi, nell’inibizione della crescita e della proliferazione cellulare, nell’arresto del ciclo cellulare e nel blocco della migrazione metastatica delle cellule tumorali, migliorando anche la sensibilità ai farmaci chemioterapici [35].
Studi scientifici hanno anche evidenziato benefici effetti della Grifola frondosa e dei suoi estratti nella regolazione della pressione sanguigna [36], del profilo lipidemico [37] e soprattutto di quello glicemico, mostrando un’attività ipoglicemizzante grazie all’inibizione dell’α-glucosi-dasi, in grado di contrastare la stessa insulino-resistenza del paziente affetto da diabete di tipo 2 [38,39]. Le frazioni estratte dalla Grifola frondosa riducono quindi l’ipertensione correlata all’età tramite effetti sulle RAS e consentono anche di modulare l’inflammaging, contribuendo così a un’aspettativa di vita maggiore e più sana [40].
In medicina anti-aging l’impiego di questo fungo è variabile: da un effetto aspecifico sulla qualità di vita e contro le malattie cronico-degenerative a uno immunomodulante, antiglicante, antipertensivo e quindi cardioprotettivo, antinfiammatorio e potenziativo.
Il range posologico nel contesto della medicina preventiva (non a scopo terapeutico specifico, in cui si devono impiegare dosaggi decisamente maggiori) dipende dalla formulazione in commercio, in quanto lo si può trovare sotto forma sia di polvere secca sia di estratto secco standardizzato (in genere titolato 30:1). Indicativamente, come apporto puro, si suggerisce una posologia di 500-2.000 mg al giorno. Spesso viene utilizzato a cicli: 2 mesi consecutivi seguiti da 3-4 settimane di pausa e quindi ripresa del trattamento, procedendo con lo stesso andamento periodico. Per l’azione antiglicante è indicato un uso continuativo giornaliero, con dosaggio da personalizzare in funzione della risposta glicemica del singolo paziente.
AGARICUS SUBRUFESCENS PECK (AGARICUS BLAZEI MURILL, ABM)
L’ABM è ricco in particolare di α- e β-glucani e i suoi componenti si sono dimostrati attivi soprattutto sul sistema immunitario [41]. È un fungo commestibile, tradizionalmente utilizzato per combattere lo stress psico-fisico, per stimolare il sistema immunitario, come ipoglicemizzante [42], per riequilibrare il profilo lipidico [43] e come antiossidante [44].
Contiene svariati minerali (in particolare potassio, ferro, calcio, magnesio, sodio, zinco, rame, manganese e selenio), vitamine (B1, B2, B6, niacina, acido pantotenoico, acido folico, biotina, un precursore della vitamina D, vitamina E), acidi grassi (acido linoleico e palmitoleico), polisaccaridi, proteoglicani e riboglucani, steroli, fibre e tutti gli aminoacidi essenziali. Il corpo fruttifero contiene anche enzimi, quali la 1,3 glucanasi e la perossidasi.
L’ABM contiene un elevato livello di β-glucani, presenti in tre forme diverse: β-(1-3)-D-glucano, β-(1-4)-D-glucano e β-(1-6)-D-glucano, in grado di stimolare le cellule immunitarie come le cellule NK, i macrofagi, le cellule dendritiche e i leucociti polimorfonucleati [45]. Studi sugli animali e la ricerca cellulare hanno evidenziato come il consumo dell’ABM sembri presentare proprietà antitumorali [46,47] e antiangiogenetiche [48]. Studi clinici preliminari hanno anche sottolineato che l’assunzione giornaliera di questo fungo è stata in grado di migliorare la qualità di vita di pazienti in remissione da patologie neoplastiche [49,50]. L’ingestione di ABM da parte di pazienti con IBS ha comportato effetti antinfiammatori interessanti, come dimostrato dalla diminuzione dei livelli di citochine nel sangue e della calprotectina nelle feci [51].
In Asia è considerato una specie di “alimento funzionale” e, dato il suo altissimo contenuto in β-glucani, molto maggiore di quello del reishi, dello shiitake e del maitake, è impiegato nella medicina preventiva e potenziativa [52] e per l’ottimizzazione del benessere psico-fisico. Il range posologico è legato alla standardizzazione e alla titolazione del prodotto. Come base possiamo riferirci alla pura polvere e/o a un estratto secco su maltodestrine di ABM titolato al 40-50% da solo o in associazione con pura polvere; il dosaggio giornaliero è compreso tra 750 e 2.000 mg di estratto fungino puro, da suddividersi in due-tre somministrazioni.
CORDYCEPS SINENSIS
Il Cordyceps sinensis (Figura 15.5) è un Ascomycota parassita di un lepidottero della famiglia delle Hepialidae, di cui invade progressivamente la larva affondata nel terreno. Il nome Cordyceps deriva dal greco kordúle = “clava” e dal suffisso latino ceps (da caput) = “capo, testa”, esplicito richiamo alla forma che assume fuoriuscendo dalla larva mummificata di un lepidottero, generalmente l’Hepialus armoricanus. Negli Stati Uniti prende invece il nome di “caterpillar fungus”, cioè “fungo del bruco”, proprio a causa del particolare ciclo biologico che lo caratterizza: dopo essere germinato all’interno della larva, il Cordyceps uccide e mummifica l’organismo, fino a fuoriuscire attraverso la sua testa.
La scienza moderna sta cercando di confermare con studi scientifici l’efficacia del Cordyceps sinensis nelle problematiche per le quali è stato tradizionalmente utilizzato; tuttavia anche per questo fungo non esistono studi che attualmente possano essere considerati completi dal punto di vista dell’evidencebased medicine.
Gli impieghi tradizionali riguardano la benefica influenza sulla funzionalità del sistema immunitario, mediata non solo dall’aumento del numero e dell’efficacia delle cellule dell’immunità aspecifica Natural Killer (NK), ma anche grazie all’induzione della risposta cellulomediata del sistema immunitario specifico, oltre che da un’intrinseca attività di regolazione della risposta infiammatoria [53-55].
Studi scientifici ne hanno messo in evidenza l’azione epatoprotettiva ed epatorigenerativa: è stato dimostrato che questo fungo risulta in grado di migliorare la funzionalità epatica, di contribuire alla rigenerazione del parenchima epatico in caso di fibrosi o cirrosi, di ridurre la carica virale e i danni epatici in corso di epatiti virali e di normalizzare gli enzimi epatici [56,57]. Altri vantaggi risiedono nella regolazione del ritmo cardiaco (aritmie, extrasistoli, tachicardie) e nella riduzione del rischio cardiovascolare [58,59]. A livello metabolico contribuisce a regolarizzare i livelli di colesterolo, riducendo il colesterolo totale, aumentando l’HDL e abbassando i trigliceridi [60].
Il Cordyceps sinensis contiene una grande variabilità di sostanze biologicamente attive considerate importanti dal punto di vista nutrizionale: svariati minerali (in particolare potassio, sodio, calcio, magnesio, ferro, rame, manganese, zinco, selenio, silicio, gallio, cromo, vanadio, zirconio, titanio, nickel e stronzio); vitamine (B1, B2, B12, E, K); poli-, mono-, di- e oligosaccaridi, tra cui l’acido cordicepico e il galattomannano; fitosteroli, quali l’ergosterolo (importante precursore della vitamina D), il β-3-ergosterolo, l’ergosterolo perossido, il 3-sitosterolo, il daucosterolo, il campesterolo e altri ancora; fibre; β-glucani, β-mannani; acidi grassi sia saturi (acido palmitico in particolare) sia insaturi (soprattutto acido linoleico e oleico) e tutti gli aminoacidi essenziali.
Tra i componenti bioattivi più potenti ci sono gli analoghi dei nucleosidi, non riscontrabili in altri rimedi naturali: la cordicepina (3’-deossiadenosina), l’acido cordicepico, la 2’-deossiadenosina e altri analoghi dei nucleotidi deossigenati (uridina, deossiuridina, adenosina, dideossiadenosina) [61,62]. In particolare, la cordicepina si è dimostrata assai efficace nei confronti di alcuni virus e di ceppi batterici che hanno sviluppato resistenze antibiotiche [63].
L’utilizzo regolare del Cordyceps sinensis incrementa di quasi il 30%, ma talvolta fino al 55%, i livelli di ATP (adenosina-trifosfato) nell’organismo e del 30-40% la capacità dell’organismo di utilizzare l’ossigeno, da cui l’impiego come energizzante sia in chiave di medicina anti-aging sia nel contesto della medicina sportiva. Infatti, lo sportivo può trarre concreti benefici dall’impiego del Cordyceps sinensis, che si è dimostrato utile nel promuovere l’ossigenazione dei tessuti attraverso il rilassamento della muscolatura bronchiale, bronchiolare e della parete vasale, determinando un aumento del flusso ematico a livello muscolare e cardiaco e conseguentemente un più efficace utilizzo dell’ossigeno da parte dell’organismo, con aumento della VO2max; da questa osservazione si comprende la sua particolare utilità negli sport di resistenza [64-66]. Da tali osservazioni è derivato anche il suo impiego nelle malattie dell’apparato respiratorio e nell’asma [67].
Studi clinici hanno dimostrato anche un migliore recupero dell’energia e un effetto antiaffaticamento. Nello sportivo la sua assunzione permette quindi di migliorare la performance aerobica, di velocizzare i tempi di recupero muscolare e la clearance dell’acido lattico, nonché un’azione anabolica a livello muscolare, attribuibile a un aumento del testosterone durante l’attività fisica. Tra gli studi scientifici in vivo è di particolare interesse quello in doppio cieco recentemente effettuato presso l’Università di Pavia su un gruppo di ciclisti non professionisti, in cui vengono descritti gli effetti sui livelli di testosterone e cortisolo (T/C) in seguito a un’integrazione fungina di Cordyceps sinensis associato a reishi, per determinarne il rapporto tra anabolismo e catabolismo. I risultati emersi con lo studio sono notevoli: l’aumento massimo dei livelli di testosterone è risultato del 249,5%, mentre il calo massimo dei livelli di cortisolo è stato del –77,1%. Lo studio ha anche permesso di sottolineare che si rendono necessari almeno 3 mesi di integrazione per il conseguimento dei miglioramenti obiettivati. Dopo un mese dalla sospensione dell’integrazione fungina, il rapporto T/C pregara si manteneva elevato e significativamente differente dal placebo iniziale, mentre il rapporto T/C post-gara tendeva a ritornare ai valori iniziali, non proteggendo più l’atleta dallo stress imposto dall’esercizio fisico [68].
Attualmente le due categorie di soggetti che usano il Cordyceps sinensis come tonico sono rappresentate soprattutto dagli atleti e dagli anziani. Studi controllati su gruppi di anziani hanno dimostrato, dopo un mese di utilizzo, una notevole diminuzione della stanchezza, della freddolosità e della confusione mentale [65]. I suoi effetti sono legati anche all’azione antiossidante, anti-aging e di protezione cellulare dai radicali liberi. Da queste osservazioni derivano gli impieghi nel contesto della medicina anti-aging e rigenerativa. Il Cordyceps sinensis è un adattogeno particolarmente efficace, in grado di aumentare le difese immunitarie da una parte e l’energia dell’organismo dall’altra, di calmare la mente e di potenziare il fisico, di modulare l’umore e di ridurre gli effetti sull’organismo correlati al processo di invecchiamento [69,70]. Il range posologico è compreso tra 500 e 1.500 mg al giorno, in due-tre somministrazioni; il suo assorbimento e la sua efficacia sono aumentati dalla contemporanea assunzione di vitamina C, che favorisce l’assorbimento enterico dei suoi polisaccaridi.
HERICIUM ERINACEUS (POMPON BLANC)
L’Hericium erinaceus è un fungo che abita le zone montane dei territori nord-orientali dell’Asia. Si può tuttavia reperire anche in Italia, in particolare in ambienti termofili o mediterranei del Centro-sud e delle isole maggiori, dove cresce per lo più su vecchie querce, anche sempreverdi, come la sughera (Quercus suber). Yamabushitake è il nome con cui è chiamato in Asia e soprattutto in Giappone, che deriva dall’unione della parola “take”, che significa fungo, e “yamabushi”, che indica i monaci eremiti giapponesi che vivevano sulle montagne. È stato utilizzato nella medicina popolare tradizionale in Cina, Corea e Giappone per una serie di effetti fisiologici, tra cui un’attività antinvecchiamento, antiossidante, antiproliferativa, eu¬peptica e prometabolica. Pertanto, può costituire un’interessante risorsa di destinazione per lo sviluppo non solo di farmaci, ma anche di alimenti funzionali (“functional food”) [78].
L’Hericium erinaceus apporta svariati aminoacidi essenziali e oligoelementi, tra cui selenio, ferro e germanio, oltre che β-glucani e altri importanti principi attivi, quali gli ericenoni e le erina¬cine, capaci di interagire, in modo elettivo e sinergico, a livello sia dell’apparato gastroenterico sia del sistema nervoso. La comprensione delle funzioni fisiologiche dell’Hericium erinaceus e l’identificazione chimica dei suoi principi attivi hanno compiuto progressi nell’arco degli ultimi decenni, in particolare in merito alle funzioni antitumorali e neuroprotettive.
Negli animali da esperimento, l’estratto acquoso di Hericium erinaceus ha evidenziato capacità gastroprotettive, così come una significativa riduzione delle aree interessate da ulcere indotte. L’analisi immunoistochimica, inoltre, ha dimostrato un’upregulation delle proteine HSP70 e una downregulation delle proteine BAX. In conclusione, questi studi hanno rimarcato come i composti bioattivi presenti nell’estratto acquoso di Hericium erinaceus possano giocare un ruolo importante nell’attività gastroprotettiva [79].
In tema di neuroprotezione, l’Hericium erinaceus si è dimostrato in grado di stimolare la sintesi del Nerve Growth Factor (NGF, fattore di crescita nervoso), con le conseguenti ricadute favorevoli in termini di neurotrofismo e salute neuronale [80,81]. L’Hericium erinaceus si è anche dimostrato utile nel migliorare il quadro sintomatologico associato al degrado cognitivo lieve (Mild Cognitive Impairment, MCI), che spesso precede di anni la comparsa della malattia di Alzheimer [82], contribuendo in generale a un’azione volta a contrastare l’invecchiamento cerebrale [83].
Nel contesto dell’azione antiproliferativa, sono stati osservati interessanti risultati nel trattamen¬to, ad esempio, di neoplasie gastriche, sia impiegato da solo sia in associazione con farmaci chemioterapici tradizionali; tuttavia, sono necessari ulteriori studi per individuare i costituenti chimici attivi e capirne il meccanismo di azione e l’effettiva efficacia antitumorale in vivo [84].
In medicina anti-aging, l’Hericium erinaceus viene tradizionalmente utilizzato:
• per le problematiche gastriche, grazie alla sua attività antinfiammatoria e cicatrizzante e alla capacità di rigenerazione delle mucose;
• a supporto delle funzioni nervose, dato che vari studi scientifici hanno permesso di identificare composti in grado di attraversare la barriera ematoencefalica e di stimolare la rigenerazione mielinica, così come di esercitare un’attività neurotrofica e neuroprotettiva, favorendo il mantenimento delle normali funzioni cognitive [85,86];
• nella prevenzione del danno ischemico neuronale [87]. La posologia suggerita in termini di estratto secco puro, ottenuto da corpi fruttiferi selezionati ed essiccati, la cui successiva macinazione ne determina una migliore biodisponibilità, è compresa in un range tra 800 e 2.000 mg al giorno, suddivisi in due-tre somministrazioni.
------------------------------------------------------
ATTENZIONE PERÒ AD UN PARTICOLARE
Bisogna però fare molta attenzione alla sicurezza dei funghi in generale e dei funghi medicinali in particolare, perché questa dipende dalla fonte dei funghi, dal metodo di estrazione e dalla purezza dei loro polisaccaridi. Alcuni funghi possono contenere composti nocivi, come i metalli pesanti e alcune micotossine che, se i funghi vengono consumati in grandi quantità, possono causare disturbi gastrointestinali, mal di testa, affaticamento e crampi muscolari,specialmente in soggetti con una debole funzionalità epatica.
Comunque, se gli integratori di funghi medicinali sono prodotti da una ditta seria, sono sicuramente ben tollerati e svolgono un ruolo positivo nel mantenimento e nel ripristino della nostra salute globale, ma anche nell’aumentare le nostre difese antivirali e antiossidanti, che oggi sono particolarmente fragili nella maggior parte dei soggetti, specie i bambini, gli anziani e le persone affette da una o più patologie croniche.
PER MAGGIORI INFORMAZIONI CONTATTACI:
ERBORISTERIA ARCOBALENO
Specialisti in MICOTERAPIA
Tel. 3200469843 / 0445-524576
info@erboristeriarcobaleno.com
FONTE:
- D. Galimberti, R. Galli, in https://www.medicalinformation.it/pub/media/blfa_files/9788821440120.pdf
- L’immagine è tratta dal libro: Ivo Bianchi, MICOTERAPIA, i funghi medicinali nella pratica clinica, Palermo, Nuova Ipsa Editore, 2008
BIBLIOGRAFIA
1. Sullivan R et al. Medicinal mushrooms and cancer therapy: translating a traditional practice into Western medicine. Perspect Biol Med. 2006 Spring;49(2):159-70.
2. Durgo K et al. Cytotoxicity of blended versus single medicinal mushroom extracts on human cancer cell lines: contribution of polyphenol and polysaccharide content. Int J Med Mushrooms. 2013;15(5):435-48.
3. Popovic V et al. Mycotherapy of cancer: an update on cytotoxic and antitumor activities of mushrooms, bioactive principles and molecular mechanisms of their action. Curr Top Med Chem. 2013;13(21):2791-806.
4. Petrova RD. New scientific approaches to cancer treatment: can medicinal mushrooms defeat the curse of the century? Int J Med Mushrooms. 2012;14(1):1-20.
5. Chang ST et al. The role of culinary-medicinal mushrooms on human welfare with a pyramid model for human health. Int J Med Mushrooms. 2012;14(2):95-134.
6. Sanodiya BS et al. Ganoderma lucidum: a potent pharmacological macrofungus. Curr Pharm Biotechnol. 2009 Dec;10(8):717-42.
7. Boh B et al. Ganoderma lucidum and its pharmaceutically active compounds. Biotechnol Annu Rev. 2007;13:265-301.
8. Gao Y et al. Effects of ganopoly (a Ganoderma lucidum polysaccharide extract) on the immune functions in advanced-stage cancer patients. Immunol Invest. 2003 Aug;32(3):201-15
9. Loganathan J et al. The mushroom Ganoderma lucidum suppresses breast-to-lung cancer metastasis through the inhibition of pro-invasive genes. Int J Oncol. 2014 Jun;44(6):2009-
10. Batra P et al. Probing Lingzhi or Reishi medicinal mushroom Ganoderma lucidum (higher Basidiomycetes): a bitter mushroom with amazing health benefits. Int J Med Mushrooms. 2013;15(2):127-43.
11. Wachtel-Galor S et al. Herbal Medicine, 2nd edition – Biomolecular and Clinical Aspects. CRC Press, Boca Raton (FL), 2011, chapter 9.
12. Shen B et al. An in vitro study of neuroprotective properties of traditional Chinese herbal medicines thought to promote healthy ageing and longevity. BMC Complement Altern Med. 2013 Dec 27;13:373.
13. Chuang MH et al. The lifespan-promoting effect of acetic acid and Reishi polysaccharide. Bioorg Med Chem. 2009 Nov 15;17(22):7831-40.
14. [Xu X et al. Polysaccharides in Lentinus edodes: isolation, structure, immunomodulating activity and future prospective. Crit Rev Food Sci Nutr. 2014;54(4):474-87.
15. Zheng R et al. Characterization and immunomodulating activities of polysaccharide from Lentinus edodes. Int Immunopharmacol. 2005 May;5(5):811-20.
16. Carneiro AA et al. Chemical composition and antioxidant activity of dried powder formulations of Agaricus blazei and Lentinus edodes. Food Chem. 2013 Jun 15;138(4):2168-73.
17. [Gunawardena D et al. Determination of anti-inflammatory activities of standardised preparations of plant-and mushroom-based foods. Eur J Nutr. 2014 Feb;53(1):335-43.
18. Nishitani Y et al. Intestinal anti-inflammatory activity of lentinan: influence on IL-8 and TNFR1 expression in intestinal epithelial cells. PLoS One. 2013 Apr 22;8(4):e62441.
19. Bisen PS et al. Lentinus edodes: a macrofungus with pharmacological activities. Curr Med Chem. 2010;17(22):2419-30.
20. Li X et al. Antiproliferative protein from the culture supernatant of Lentinula edodes C91-3 mycelia. J Agric Food Chem. 2014 Jun 11;62(23):5316-20.
21. Ann XH et al. Expression and characterization of protein Latcripin-3, an antioxidant and antitumor molecule from Lentinula edodes C91-3. Asian Pac J Cancer Prev. 2014;15(12):5055-61.
22. Mascaraque C et al. Active hexose correlated compound exerts therapeutic effects in lymphocyte driven colitis. Mol Nutr Food Res. 2014 Dec;58(12):2379-82.
23. Yin Z et al. Effects of active hexose correlated compound on frequency of CD4+ and CD8+ T cells producing interferon-g and/or tumor necrosis factor-ain healthy adults. Hum Immunol. 2010 Dec;71(12):1187-90.
24. Gao Y et al. Active hexose correlated compound enhances tumor surveillance through regulating both innate and adaptive immune responses. Cancer Immunol Immunother. 2006 Oct;55(10):1258-66.
25. Hirahara N et al. Protein-bound polysaccharide-K induces apoptosis via mitochondria and p38 mitogen-activated protein kinase-dependent pathways in HL-60 promyelomonocytic leukemia cells. Oncol Rep. 2013 Jul;30(1):99-104.
26. Sekhon BK et al. PSP activates monocytes in resting human peripheral blood mononuclear cells: immunomodulatory implications for cancer treatment. Food Chem. 2013 Jun 15;138(4):2201-9.
27. Nakazato H et al. Efficacy of immunochemotherapy as adjuvant treatment after curative resection of gastric cancer. Study Group of Immunochemotherapy with PSK for Gastric Cancer. Lancet. 1994 May 7;343(8906):1122-6.
28. Ohwada S et al. Adjuvant immunochemotherapy with oral Tegafur/Uracil plus PSK in patients with stage II or III colorectal cancer: a randomised controlled study. Br J Cancer. 2004 Mar 8;90(5):1003-10.
29. Toth B et al. Effects of VPS extract of Coriolus versicolor on cancer of the large intestine using a serial sacrifice technique. In Vivo. 2006 May-Jun;20(3):341-6.
30. Szeto YT et al. Direct human DNA protection by Coriolus versicolor (Yunzhi) extract. Pharm Biol. 2013 Jul;51(7):851-5.
31. Jiang J et al. Novel medicinal mushroom blend suppresses growth and invasiveness of human breast cancer cells. Int J Oncol. 2010 Dec;37(6):1529-36.
32. Kodama N et al. Effect of Maitake (Grifola frondosa) D-Fraction on the activation of NK cells in cancer patients. J Med Food. 2003 Winter;6(4):371-7.
33. Kodama N et al. Maitake D-Fraction enhances antitumor effects and reduces immunosuppression by mitomycin-C in tumor-bearing mice. Nutrition. 2005 May;21(5):624-9.
34. Soares R et al. Maitake (D fraction) mushroom extract induces apoptosis in breast cancer cells by BAK-1 gene activation. J Med Food. 2011 Jun;14(6):563-72.
35. Alonso E et al. Genes related to suppression of malignant phenotype induced by Maitake D-Fraction in breast cancer cells. J Med Food. 2013 Jul;16(7):602-17.
36. Preuss HG et al. Fraction SX of maitake mushroom favorably influences blood glucose levels and blood pressure in streptozotocin-induced diabetic rats. J Med Food. 2012 Oct;15(10):901-8.
37. Sato M et al. Effect of dietary Maitake (Grifola frondosa) mushrooms on plasma cholesterol and hepatic gene expression in cholesterol-fed mice. J Oleo Sci. 2013;62(12):1049-58.
38. Su CH et al. Inhibitory potential of Grifola frondosa bioactive fractions on α-amylase and α-glucosidase for management of hyperglycemia. Biotechnol Appl Biochem. 2013 Jul-Aug;60(4):446-52.
39. Lei H et al. Hypoglycemic and hypolipidemic activities of MT-a-glucan and its effect on immune function of diabetic mice. Carbohydr Polym. 2012 Jun 5;89(1):245-50.
40. Preuss HG et al. Maitake mushroom extracts ameliorate progressive hypertension and other chronic metabolic perturbations in aging female rats. Int J Med Sci. 2010 Jun 7;7(4):169-80.
41. Hetland G et al. Effects of the medicinal mushroom Agaricus blazei Murill on immunity, infection and cancer. Scand J Immunol. 2008 Oct;68(4):363-70.
42. Vincent M et al. Dietary supplementation with Agaricus blazei Murill extract prevents diet-induced obesity and insulin resistance in rats. Obesity (Silver Spring). 2013 Mar;21(3):553-61.
43. Liu Y et al. Immunomodulating activity of Agaricus brasiliensis KA21 in mice and in human volunteers. Evid Based Complement Alternat Med. 2008 Jun;5(2):205-19.
44. Hakime-Silva RA et al. Chemical, enzymatic and cellular antioxidant activity studies of Agaricus blazei Murrill. An Acad Bras Cienc. 2013 Sep;85(3):1073-81.
45. Forland DT et al. An extract based on the medicinal mushroom Agaricus blazei Murill stimulates monocyte-derived dendritic cells to cytokine and chemokine production in vitro. Cytokine. 2010 Mar;49(3):245-50.
46. da Silva AF et al. Effects of b-glucan extracted from Agaricus blazei on the expression of ERCC5, CASP9, and CYP1A1 genes and metabolic profile in HepG2 cells. Hum Exp Toxicol. 2013 Jun;32(6):647-54.
47. Ishii PL et al. Evaluation of Agaricus blazei in vivo for antigenotoxic, anticarcinogenic, phagocytic and immunomodulatory activities. Regul Toxicol Pharmacol. 2011 Apr;59(3):412-22.
48. Niu YC et al. A low molecular weight polysaccharide isolated from Agaricus blazei suppresses tumor growth and angiogenesis in vivo. Oncol Rep. 2009 Jan;21(1):145-52.
49. Ohno S et al. Quality of life improvements among cancer patients in remission following the consumption of Agaricus blazei Murill mushroom extract. Complement Ther Med. 2013 Oct;21(5):460-7.
50. Ohno S et al. Phase I clinical study of the dietary supplement, Agaricus blazei Murill, in cancer patients in remission. Evid Based Complement Alternat Med. 2011;2011:192381.
51. Forland DT et al. Effect of an extract based on the medicinal mushroom Agaricus blazei Murill on expression of cytokines and calprotectin in patients with ulcerative colitis and Crohn’s disease. Scand J Immunol. 2011 Jan;73(1):66-75.
52. Hetland G et al. The mushroom Agaricus blazei Murill elicits medicinal effects on tumor, infection, allergy, and inflammation through its modulation of innate immunity and amelioration of Th1/Th2 imbalance and inflammation. Adv Pharmacol Sci. 2011;2011:157015.
53. Koh JH et al. Activation of macrophages and the intestinal immune system by an orally admini-stered decoction from cultured mycelia of Cordyceps sinensis. Biosci Biotechnol Biochem. 2002 Feb;66(2):407-11.
54. Jordan JL et al. Immune activation by a sterile aqueous extract of Cordyceps sinensis: mechanism of action. Immunopharmacol Immunotoxicol. 2008;30(1):53-70.
55. Choi YH et al. Anti-inflammatory effects of cordycepin in lipopolysaccharide-stimulated RAW 264.7 macrophages through Toll-like receptor 4-mediated suppression of mitogen-activated protein kinases and NF-kB signaling pathways. Drug Des Devel Ther. 2014 Oct 16;8:1941-53.
56. Peng Y et al. Cultured mycelium Cordyceps sinensis protects liver sinusoidal endothelial cells in acute liver injured mice. Mol Biol Rep. 2014 Mar;41(3):1815-27.
57. Ko WS et al. Compound Cordyceps TCM-700C exhibits potent hepatoprotective capability in animal model. Fitoterapia. 2010 Jan;81(1):1-7.
58. Yan XF et al. Cardiovascular protection and antioxidant activity of the extracts from the mycelia of Cordyceps sinensis act partially via adenosine receptors. Phytother Res. 2013 Nov;27(11):1597-604.
59. Mei QB et al. Antiarrhythmic effects of Cordyceps sinensis (Berk.) Sacc. Zhongguo Zhong Yao Za Zhi. 1989 Oct;14(10):616-8, 640.
60. Koh JH et al. Hypocholesterolemic effect of hot-water extract from mycelia of Cordyceps sinensis. Biol Pharm Bull. 2003 Jan;26(1):84-7.
61. Ren Z et al. Cordycepin suppresses TNF-a-induced NF-kB activation by reducing p65 transcriptional activity, inhibiting IkBaphosphorylation, and blocking IKKg ubiquitination. Int Immunopharmacol. 2012 Dec;14(4):698-703.
62. Lee HJ et al. The nucleoside antagonist cordycepin causes DNA double strand breaks in breast cancer cells. Invest New Drugs. 2012 Oct;30(5):1917-25.
63. Ueda Y et al. Anti-HCV activity of the Chinese medicinal fungus Cordyceps militaris. Biochem Biophys Res Commun. 2014 May 2;447(2):341-5.
64. Chen S et al. Effect of Cs-4 (Cordyceps sinensis) on exercise performance in healthy older subjects: a double-blind, placebo-controlled trial. J Altern Complement Med. 2010 May;16(5):585-90.
65. Kumar R et al. Cordyceps sinensis promotes exercise endurance capacity of rats by activating skeletal muscle metabolic regulators. J Ethnopharmacol. 2011 Jun 14;136(1):260-6.
66. Chen CY et al. Rhodiola crenulata- and Cordyceps sinensis- based supplement boosts aerobic exercise performance after short-term high altitude training. High Alt Med Biol. 2014 Sep;15(3):371-9.
67. Kuo YC et al. Regulation of bronchoalveolar lavage fluids cell function by the immunomodulatory agents from Cordyceps sinensis. Life Sci. 2001 Jan 19;68(9):1067-82.
68. Rossi P et al. “Integratori alimentari a base di Cordyceps sinensis e Ganoderma lucidum: effetti sul rapporto testosterone/cortisolo in un gruppo di sportivi”. Congresso Interdisciplinare sulle Piante Medicinali 31May/2 Jun 2012.
69. Wang YH et al. An experimental study on anti-aging action of Cordyceps extract. Zhongguo Zhong Yao Za Zhi. 2004 Aug;29(8):773-6.
70. Niwa Y et al. Evidence That Naturopathic Therapy Including Cordyceps sinensis Prolongs Survival of Patients With Hepatocellular Carcinoma. Integr Cancer Ther. 2012 Apr 26.
71. Hsieh MJ et al. Hispolon from Phellinus linteus possesses mediate caspases activation and induces human nasopharyngeal carcinomas cells apoptosis through ERK1/2, JNK1/2 and p38 MAPK pathway. Phytomedicine. 2014 Oct 15;21(12):1746-52.
72. Lee YS et al. Protein glycation inhibitors from the fruiting body of Phellinus linteus. Biol Pharm Bull. 2008 Oct;31(10):1968-72.
73. Lee YS et al. Inhibition of protein tyrosine phosphatase 1beta by hispidin derivatives isolated from the fruiting body of Phellinus linteus. Nat Prod Commun. 2010 Dec;5(12):1927-30.
74. Konn S et al. Potent anticancer effects of bioactive mushroom extracts (Phellinus linteus) on a variety of human cancer cells. J Clin Med Res. 2015 Feb;7(2):76-82.
75. Huang GJ et al. Anti-inflammatory activities of inotilone from Phellinus linteus through the inhibition of MMP-9, NF-kB, and MAPK activation in vitro and in vivo. PLoS One. 2012;7(5):e35922.
76. Lee YS et al. Anti-angiogenic activity of methanol extract of Phellinus linteus and its fractions. J Ethnopharmacol. 2010 Aug 19;131(1):56-62.
77. Chen YC et al. Hispolon from Phellinus linteus induces G0/G1 cell cycle arrest and apoptosis in NB4 human leukaemia cells. Am J Chin Med. 2013;41(6):1439-57.
78. Wang M et al. Hericium erinaceus (Yamabushitake): a unique resource for developing functional foods and medicines. Food Funct. 2014 Nov 19;5(12):3055-64.
79. Wong JY et al. Gastroprotective effects of lion’s mane mushroom Hericium erinaceus (Bull.: Fr.) Pers. (Aphyllophoromycetideae) extract against ethanol-induced ulcer in rats. Evid Based Complement Alternat Med. 2013;2013:492976.
80. Mori K et al. Nerve growth factor-inducing activity of Hericium erinaceus in 1321N1 human astrocytoma cells. Biol Pharm Bull. 2008 Sep;31(9):1727-32.
81. Phan CW et al. Hericium erinaceus (Bull.: Fr) Pers. cultivated under tropical conditions: isolation of hericenones and demonstration of NGF-mediated neurite outgrowth in PC12 cells via MEK/ERK and PI3K-Akt signaling pathways. Food Funct. 2014 Nov 19;5(12):3160-9.
82. Mori K et al. Improving effects of the mushroom Yamabushitake (Hericium erinaceus) on mild cognitive impairment: a double-blind placebo-controlled clinical trial. Phytother Res. 2009 Mar;23(3):367-72.
83. Phan CW et al. Therapeutic potential of culinary-medicinal mushrooms for the management of neurodegenerative diseases: diversity, metabolite, and mechanism. Crit Rev Biotechnol. 2014 Mar 24.
84. Li G et al. Anticancer potential of Hericium erinaceus extracts against human gastrointestinal cancers. J Ethnopharmacol. 2014 Apr 28;153(2):521-30.
85. Wong KH et al. Neuroregenerative potential of lion’s mane mushroom, Hericium erinaceus (Bull.: Fr.) Pers. (higher Basidiomycetes), in the treatment of peripheral nerve injury (review). Int J Med Mushrooms. 2012;14(5):427-46.
86. Mori K et al. Effects of Hericium erinaceus on amyloid b(25-35) peptide-induced learning and memory deficits in mice. Biomed Res. 2011 Feb;32(1):67-72.
87. Lee KF et al. Protective effects of Hericium erinaceus mycelium and its isolated erinacine A against ischemia-injury-induced neuronal cell death via the inhibition of iNOS/p38 MAPK and nitrotyrosine. Int J Mol Sci. 2014 Aug 27;15(9):15073-89.
© Pensi che questo testo violi qualche norma sul copyright, contenga abusi di qualche tipo? Contatta il responsabile o Leggi come procedere

